¡Bienvenidos a este blog!
Encontraran diversos temas a cerca de la Bioquímica Clínica, que les ayudaran a reforzar conocimientos o en la realización de trabajos.
Disfruten del contenido.💕
Bioquimica Clinica
¡Bienvenidos a este blog! Disfruten de temas interesantes sobre Bioquímica Clínica.
lunes, 2 de marzo de 2099
lunes, 3 de abril de 2017
lunes, 6 de marzo de 2017
domingo, 5 de marzo de 2017
jueves, 23 de febrero de 2017
Proceso de Glucolisis
Explicación de las reacciones de la glucólisis
1. Fosforilación de la glucosa
REACCIÓN: Es activada por la glucosa. Irreversible bajo condiciones intracelulares, utiliza ATP.
ENZIMA: Hexocinasa.
2. Cambio de glucosa 6-fosfato a fructosa 6-fosfato (isomerización de G6P)
REACCIÓN: Isomerización reversible de aldosa a cetosa.
ENZIMA: Fosfofructoisomerasa.
3. Fosforilación de fructosa 6-fosfato a fructosa 1,6-bifosfato
REACCIÓN: Fosforilación, utiliza ATP; transferencia de un grupo fosfato de ATP a fructosa 6-fosfato.
Paso comprometedor: punto principal de regulación.
Reacción irreversible bajo condiciones celulares.
ENZIMA: Fosfofructocinasa-1 (PKF-1).
4. Rompimiento de fructosa 1,6-bifosfato
REACCIÓN: Condensación aldólica reversible.
ENZIMA: Aldolasa (aldolasa fructosa 1,6-bifosfato)
5. Interconversión de triosas fosfatadas
REACCIÓN: Isomerización.
Sólo el gliceraldehído 3-fosfato sigue la glicólisis.
Se completa la fase preparatoria. La hexosa ha sido fosforilada en los carbonos 1 y 6, y se rompe en dos moléculas de GAP.
ENZIMA: Isomerasa de triosa fosfato.
6. Oxidación de gliceraldehído 3-fosfato para dar 1,3-bifosfoglicerato
REACCIÓN: Oxidación (el grupo aldehído es deshidrogenado para producir un anhídrido carboxílico). Aceptador de H es el NAD+.
Primer paso de la fase productiva.
ENZIMA: Triosa fosfato deshidrogenasa.
7. Transferencia del fosfato de 1,3-bifosfoglicerato a ADP
REACCIÓN: Reacción en donde se produce el primer ATP.
La energía liberada por la oxidación de un grupo aldehído a un grupo carboxílico se conserva por la formación acoplada de ATP (fosforilación a nivel de sustrato).
ENZIMA: Fosfoglicerocinasa.
8. Conversión de 3-fosfoglicerato a 2-fosfoglicerato
REACCIÓN: Isomerización.
Cambio reversible.
2,3-BPG afecta la afinidad de enlace de oxígeno debido a la velocidad de la glicólisis.
ENZIMA: Fosfogliceromutasa (transferencia de un grupo funcional de una posición a otra en la misma molécula).
9. Deshidratación de 2-fosfoglicerato para dar 2-fosfoenolpiruvato
REACCIÓN: Deshidratación (remueve una molécula de agua).
Segunda reacción en donde se produce un compuesto de alta energía.
ENZIMA: Enolasa.
10. Transferencia de fosfato de fosfoenolpiruvato a ADP
REACCIÓN: Fosforilación a nivel de sustrato; esencialmente irreversible bajo condiciones intracelulares.
Acopla la energía libre de la hidrólisis de fosfoenolpiruvato (PEP) a la síntesis de ATP.
ENZIMA: Piruvato cinasa.
Proceso del ciclo de krebs
Reacción 1: Citrato sintasa (De oxalacetato a citrato)
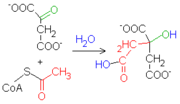 El sitio activo de la enzima, activa el acetil-CoA para hacerlo afín a un centro carbonoso del oxalacetato. Como consecuencia de la unión entre las dos moléculas, el grupo tioéster (CoA) se hidroliza, formando así la molécula de citrato.
El sitio activo de la enzima, activa el acetil-CoA para hacerlo afín a un centro carbonoso del oxalacetato. Como consecuencia de la unión entre las dos moléculas, el grupo tioéster (CoA) se hidroliza, formando así la molécula de citrato. La reacción es sumamente exoergónica (ΔG'°=-31.4 kJ/mol), motivo por el cual este paso es irreversible. El citrato producido por la enzima, además, es capaz de inhibir competitivamente la actividad de la enzima.
Reacción 2: Aconitasa (De citrato a isocitrato)
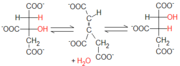 La aconitasa cataliza la isomerización del citrato a isocitrato, por la formación de cis-aconitato. La enzima cataliza también la reacción inversa, pero en el ciclo de Krebs tal reacción es unidireccional a causa de la ley de acción de masa: las concentraciones (en condiciones estándar) de citrato (91%), del intermediario cis-aconitato (3%) y de isocitrato (6%), empujan decididamente la reacción hacia la producción de isocitrato.
La aconitasa cataliza la isomerización del citrato a isocitrato, por la formación de cis-aconitato. La enzima cataliza también la reacción inversa, pero en el ciclo de Krebs tal reacción es unidireccional a causa de la ley de acción de masa: las concentraciones (en condiciones estándar) de citrato (91%), del intermediario cis-aconitato (3%) y de isocitrato (6%), empujan decididamente la reacción hacia la producción de isocitrato. En el sitio activo de la enzima está presente un clúster hierro-azufre que, junto a algunos residuos de aminoácidos polares, liga el sustrato. En concreto, la unión al sustrato se asegura por la presencia de un resto de serina, de arginina, de histidina y de aspartato, que permiten sólo la unión estereospecifica del citrato 1R,2S, rechazando la forma opuesta.
Reacción 3: Isocitrato deshidrogenasa (De isocitrato a oxoglutarato)
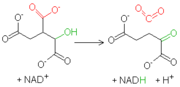 La isocitrato deshidrogenasa mitocondrial es una enzima dependiente de la presencia de NAD+ y de Mn2+ o Mg2+. Inicialmente, la enzima cataliza la oxidación del isocitrato a oxalsuccinato, lo que genera una molécula de NADH a partir de NAD+. Sucesivamente, la presencia de un ión bivalente, que forma un complejo con los oxígenos del grupo carboxilo en posición alfa, aumenta la electronegatividad de esa región molecular. Esto genera una reorganización de los electrones en la molécula, con la consiguiente rotura de la unión entre el carbono en posición gamma y el grupo carboxilo adyacente. De este modo se tiene una descarboxilación, es decir, la salida de una molécula de CO2, que conduce a la formación de α-cetoglutarato, caracterizado por dos carboxilos en las extremidades y una cetona en posición alfa con respecto de uno de los dos grupos carboxilo.
La isocitrato deshidrogenasa mitocondrial es una enzima dependiente de la presencia de NAD+ y de Mn2+ o Mg2+. Inicialmente, la enzima cataliza la oxidación del isocitrato a oxalsuccinato, lo que genera una molécula de NADH a partir de NAD+. Sucesivamente, la presencia de un ión bivalente, que forma un complejo con los oxígenos del grupo carboxilo en posición alfa, aumenta la electronegatividad de esa región molecular. Esto genera una reorganización de los electrones en la molécula, con la consiguiente rotura de la unión entre el carbono en posición gamma y el grupo carboxilo adyacente. De este modo se tiene una descarboxilación, es decir, la salida de una molécula de CO2, que conduce a la formación de α-cetoglutarato, caracterizado por dos carboxilos en las extremidades y una cetona en posición alfa con respecto de uno de los dos grupos carboxilo.Reacción 4: α-cetoglutarato deshidrogenasa (De oxoglutarato a Succinil-CoA)
Después de la conversión del isocitrato en α-cetoglutarato se produce una segunda reacción de descarboxilación oxidativa, que lleva a la formación de succinil CoA. La descarboxilación oxidativa del α-chetoglutarato es muy parecida a la del piruvato, otro α-cetoácido.
Ambas reacciones incluyen la descarboxilación de un α-cetoácido y la consiguiente producción de una unión tioéster a alta energía con la coenzima A. Los complejos que catalizan tales reacciones son parecidos entre ellos
Ambas reacciones incluyen la descarboxilación de un α-cetoácido y la consiguiente producción de una unión tioéster a alta energía con la coenzima A. Los complejos que catalizan tales reacciones son parecidos entre ellos
La α-cetoglutarato deshidrogenasa (o, más correctamente, oxoglutarato deshidrogenasa), está compuesta de tres enzimas diferentes:
* Subunidad E1: las dos cetoglutarato deshidrogenasas.
* Subunidad E2: la transuccinilasa.
(La subunidad E1 y E2 presentan una gran homología con las de la piruvato deshidrogenasa.)
* Subunidad E3: la dihidrolipoamida deshidrogenasa, que es el mismo polipéptido presente en el otro complejo enzimático.
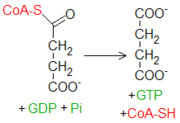 El succinil-CoA es un tioéster a alta energía (su ΔG°′ de hidrólisis está en unos -33.5 kJ mol-1, parecido al del ATP que es de -30.5 kJ mol-1). La citrato sintasa se sirve de un intermediario con tal unión a alta energía para llevar a cabo la fusión entre una molécula con dos átomos de carbono (acetil-CoA) y una con cuatro (oxalacetato). La enzima succinil-CoA sintetasa se sirve de tal energía para fosforilar un nucleósido difosfato purinico como el GDP.
El succinil-CoA es un tioéster a alta energía (su ΔG°′ de hidrólisis está en unos -33.5 kJ mol-1, parecido al del ATP que es de -30.5 kJ mol-1). La citrato sintasa se sirve de un intermediario con tal unión a alta energía para llevar a cabo la fusión entre una molécula con dos átomos de carbono (acetil-CoA) y una con cuatro (oxalacetato). La enzima succinil-CoA sintetasa se sirve de tal energía para fosforilar un nucleósido difosfato purinico como el GDP.
La energía procedente del tioéster viene convertida en energía ligada a una unión fosfato. El primer paso de la reacción genera un nuevo intermediario a alta energía, conocido como succinil fosfato. Sucesivamente, una histidina presente en el sitio catalítico remueve el fosfato de la molécula glucídica, generando el producto succinato y una molécula de fosfohistidina, que dona velozmente el fosfato a un nucleósido difosfato, recargándolo a trifosfato. Se trata del único paso del ciclo de Krebs en el que se produce una fosforilación a nivel de sustrato.
El GTP está implicado principalmente en las rutas de transducción de señales, pero su papel en un proceso energético como el ciclo de Krebs es, en cambio, esencialmente trasladar grupos fosfato hacia el ATP, en una reacción catalizada por la enzima nucleósido difosfoquinasa.
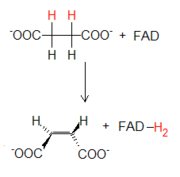 La parte final del ciclo consiste en la reorganización de moléculas a cuatro átomos de carbono hasta la regeneración del oxalacetato. Para que eso sea posible, el grupo metilo presente en el succinato tiene que convertirse en un carbonilo. Como ocurre en otras rutas, por ejemplo en la beta oxidación de los ácidos grasos, tal conversión ocurre mediante tres pasos: una primera oxidación, una hidratación y una segunda oxidación. Estos tres pasos, además de regenerar oxalacetato, permiten la extracción ulterior de energía mediante la formación de FADH2 y NADH.
La parte final del ciclo consiste en la reorganización de moléculas a cuatro átomos de carbono hasta la regeneración del oxalacetato. Para que eso sea posible, el grupo metilo presente en el succinato tiene que convertirse en un carbonilo. Como ocurre en otras rutas, por ejemplo en la beta oxidación de los ácidos grasos, tal conversión ocurre mediante tres pasos: una primera oxidación, una hidratación y una segunda oxidación. Estos tres pasos, además de regenerar oxalacetato, permiten la extracción ulterior de energía mediante la formación de FADH2 y NADH.
La primera reacción de oxidación es catalizada por el complejo enzimático de la succinato deshidrogenasa, la única enzima del ciclo que tiene como aceptor de hidrógeno al FAD en vez de al NAD+. El FAD es enlazado de modo covalente a la enzima por un residuo de histidina. La enzima se vale del FAD ya que la energía asociada a la reacción no es suficiente para reducir el NAD+.
El complejo enzimático también es el único del ciclo que pasa dentro de la membrana mitocondrial. Tal posición se debe a la implicación de la enzima en la cadena de transporte de los electrones. Los electrones pasados sobre el FAD se introducen directamente en la cadena gracias a la unión estable entre la enzima y el cofactor mismo.
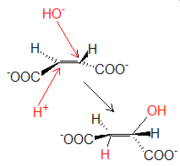 La fumarasa cataliza la adición en trans de un protón y un grupo OH- procedentes de una molécula de agua. La hidratación del fumarato produce L-malato.
La fumarasa cataliza la adición en trans de un protón y un grupo OH- procedentes de una molécula de agua. La hidratación del fumarato produce L-malato.
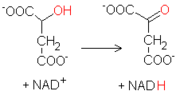 La última reacción del ciclo de Krebs consiste en la oxidación del malato a oxalacetato. La reacción, catalizada por la malato deshidrogenasa, utiliza otra molécula de NAD+ como aceptor de hidrógeno, produciendo NADH.
La última reacción del ciclo de Krebs consiste en la oxidación del malato a oxalacetato. La reacción, catalizada por la malato deshidrogenasa, utiliza otra molécula de NAD+ como aceptor de hidrógeno, produciendo NADH.
La energía libre de Gibbs asociada con esta última reacción es decididamente positiva, a diferencia de las otras del ciclo. La actividad de la enzima es remolcada por el consumo de oxalacetato por parte de la citrato sintasa, y de NADH por parte de la cadena de transporte de electrones.
* Subunidad E1: las dos cetoglutarato deshidrogenasas.
* Subunidad E2: la transuccinilasa.
(La subunidad E1 y E2 presentan una gran homología con las de la piruvato deshidrogenasa.)
* Subunidad E3: la dihidrolipoamida deshidrogenasa, que es el mismo polipéptido presente en el otro complejo enzimático.
Reacción 5: Succinil-CoA sintetasa (De Succinil-CoA a succinato)
 El succinil-CoA es un tioéster a alta energía (su ΔG°′ de hidrólisis está en unos -33.5 kJ mol-1, parecido al del ATP que es de -30.5 kJ mol-1). La citrato sintasa se sirve de un intermediario con tal unión a alta energía para llevar a cabo la fusión entre una molécula con dos átomos de carbono (acetil-CoA) y una con cuatro (oxalacetato). La enzima succinil-CoA sintetasa se sirve de tal energía para fosforilar un nucleósido difosfato purinico como el GDP.
El succinil-CoA es un tioéster a alta energía (su ΔG°′ de hidrólisis está en unos -33.5 kJ mol-1, parecido al del ATP que es de -30.5 kJ mol-1). La citrato sintasa se sirve de un intermediario con tal unión a alta energía para llevar a cabo la fusión entre una molécula con dos átomos de carbono (acetil-CoA) y una con cuatro (oxalacetato). La enzima succinil-CoA sintetasa se sirve de tal energía para fosforilar un nucleósido difosfato purinico como el GDP. La energía procedente del tioéster viene convertida en energía ligada a una unión fosfato. El primer paso de la reacción genera un nuevo intermediario a alta energía, conocido como succinil fosfato. Sucesivamente, una histidina presente en el sitio catalítico remueve el fosfato de la molécula glucídica, generando el producto succinato y una molécula de fosfohistidina, que dona velozmente el fosfato a un nucleósido difosfato, recargándolo a trifosfato. Se trata del único paso del ciclo de Krebs en el que se produce una fosforilación a nivel de sustrato.
El GTP está implicado principalmente en las rutas de transducción de señales, pero su papel en un proceso energético como el ciclo de Krebs es, en cambio, esencialmente trasladar grupos fosfato hacia el ATP, en una reacción catalizada por la enzima nucleósido difosfoquinasa.
Reacción 6: Succinato deshidrogenasa (De succinato a fumarato)
 La parte final del ciclo consiste en la reorganización de moléculas a cuatro átomos de carbono hasta la regeneración del oxalacetato. Para que eso sea posible, el grupo metilo presente en el succinato tiene que convertirse en un carbonilo. Como ocurre en otras rutas, por ejemplo en la beta oxidación de los ácidos grasos, tal conversión ocurre mediante tres pasos: una primera oxidación, una hidratación y una segunda oxidación. Estos tres pasos, además de regenerar oxalacetato, permiten la extracción ulterior de energía mediante la formación de FADH2 y NADH.
La parte final del ciclo consiste en la reorganización de moléculas a cuatro átomos de carbono hasta la regeneración del oxalacetato. Para que eso sea posible, el grupo metilo presente en el succinato tiene que convertirse en un carbonilo. Como ocurre en otras rutas, por ejemplo en la beta oxidación de los ácidos grasos, tal conversión ocurre mediante tres pasos: una primera oxidación, una hidratación y una segunda oxidación. Estos tres pasos, además de regenerar oxalacetato, permiten la extracción ulterior de energía mediante la formación de FADH2 y NADH. La primera reacción de oxidación es catalizada por el complejo enzimático de la succinato deshidrogenasa, la única enzima del ciclo que tiene como aceptor de hidrógeno al FAD en vez de al NAD+. El FAD es enlazado de modo covalente a la enzima por un residuo de histidina. La enzima se vale del FAD ya que la energía asociada a la reacción no es suficiente para reducir el NAD+.
El complejo enzimático también es el único del ciclo que pasa dentro de la membrana mitocondrial. Tal posición se debe a la implicación de la enzima en la cadena de transporte de los electrones. Los electrones pasados sobre el FAD se introducen directamente en la cadena gracias a la unión estable entre la enzima y el cofactor mismo.
Reacción 7: Fumarasa (De fumarato a L-malato)
 La fumarasa cataliza la adición en trans de un protón y un grupo OH- procedentes de una molécula de agua. La hidratación del fumarato produce L-malato.
La fumarasa cataliza la adición en trans de un protón y un grupo OH- procedentes de una molécula de agua. La hidratación del fumarato produce L-malato.Reacción 8: Malato deshidrogenasa (De L-malato a oxalacetato)
 La última reacción del ciclo de Krebs consiste en la oxidación del malato a oxalacetato. La reacción, catalizada por la malato deshidrogenasa, utiliza otra molécula de NAD+ como aceptor de hidrógeno, produciendo NADH.
La última reacción del ciclo de Krebs consiste en la oxidación del malato a oxalacetato. La reacción, catalizada por la malato deshidrogenasa, utiliza otra molécula de NAD+ como aceptor de hidrógeno, produciendo NADH. La energía libre de Gibbs asociada con esta última reacción es decididamente positiva, a diferencia de las otras del ciclo. La actividad de la enzima es remolcada por el consumo de oxalacetato por parte de la citrato sintasa, y de NADH por parte de la cadena de transporte de electrones.
Suscribirse a:
Entradas (Atom)

.jpg)







